Ammónia víz: készítmény, formula, alkalmazás
Színtelen gáz éles NH-ammónia szaggal3 nemcsak a víz feloldódása miatt melegben oldódik. Az anyag aktívan kölcsönhatásba lép a H molekulákkal2O gyenge lúg képződésével. Az oldat több nevet kapott, köztük egy - ammóniavizet. A vegyület meglepő tulajdonságokkal rendelkezik, amelyek a képződés, az összetétel és a kémiai reakciók útján vannak.
Ammónium ionképződés
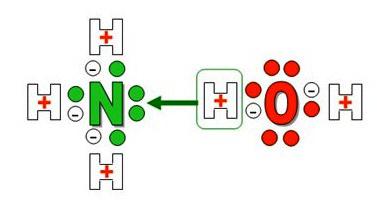
Egy pozitív ammóniumiontöltés és egy speciális gyenge kovalens kötés - donor-akceptor. Mérete, töltése és egyéb jellemzői szerint káliumkationhoz hasonlít és viselkedik, mint az alkálifémek. Szokatlanul kémiailag a vegyület savakkal reagál, sókat képeznek, amelyek nagy gyakorlati jelentőséggel bírnak. Olyan nevek, amelyekben a készítmény jellemzői és az anyag tulajdonságai tükröződnek:
- ammónia víz;
- ammónium-hidroxid;
- ammónia hidrátja;
- savas ammónium.
óvintézkedéseket
Óvatosan kell eljárni az ammónia és származékai használatakor. Fontos megjegyezni:
- Az ammóniumvíz kellemetlen szagú. A felszabaduló gáz irritálja az orrüreg nyálkahártyáját, a szemet, köhögést okoz.
- Ha az ammóniát ammóniában tárolják szorosan lezárt palackokban, az ampullák ammóniát adnak.
- A készülékek, csak szaglás nélkül, akár kis mennyiségű gázot is észlelhetnek az oldatban és a levegőben.
- Az oldatban lévő molekulák és kationok aránya különböző pH-nként változik.
- Körülbelül 7, a mérgező gáz NH koncentrációja3, az élő szervezetekkel kevésbé káros NH-kationok mennyisége nő4+
Ammónium-hidroxid előállítása. Fizikai tulajdonságok
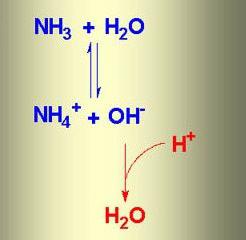
Amikor az ammóniát feloldjuk vízben, ammónia víz képződik. Ennek az anyagnak az összetétele NH4OH, de valójában vannak ionok egyidejűleg
NH4+OH-, NH3 és H2O. Az ammónia és a víz közötti ioncserélés kémiai reakciójában egyensúlyi állapot jön létre. A folyamat tükröződik egy olyan rendszer segítségével, amelyben az ellenkező irányú nyilak jelzik a jelenségek reverzibilitását.
A laboratóriumban az ammóniavíz termelését végziknitrogéntartalmú anyagokkal végzett kísérletek. Amikor ammóniát vízzel keverünk, tiszta, színtelen folyadékot kapunk. Magas nyomás esetén a gáz oldhatósága nő. A víz több oldószer feloldódik, amikor a hőmérséklet emelkedik. Az ipari szükségletekre és a mezőgazdaságra ipari méretekben 25 százalékos anyagot kap az ammónia oldódása. A második eljárás magában foglalja a kokszolókemencék gázzal való reakcióját vízzel.
Az ammónium-hidroxid kémiai tulajdonságai
Érintkezéskor két folyadék - ammónia vízés a sósav - fehér füsttel lefedve. A reakciótermék részecskéiből - ammónium-kloridból áll. Illékony anyaggal, például sósavval a reakció közvetlenül a levegőben történik.

Az ammónia-hidrát gyengén alkalikus kémiai tulajdonságai:
- Az anyag reverzibilisen disszociálja a vizet, hogy ammónium-kationt és hidroxid-iont képezzen.
- NH jelenlétében4+ a fenolftalein színtelen oldata bíborszínűvé válik, mint a lúgok esetében.
- A savakkal való semlegesítés kémiai reakciója ammónium- és vízsók képződéséhez vezet: NH4OH + HCl = NH4Cl + H2O.
- Az ammóniavíz ioncserélő reakcióba lép olyan fémsókkal, amelyekhez a gyenge bázisok felelnek meg, míg vízben oldhatatlan hidroxid képződik: 2NH4OH + CuCl2 = 2NH4Cl + Cu (OH)2 (kék csapadék).
Ammónia víz: alkalmazás a gazdaság különböző ágaiban
Szokatlan anyag széles körben használatos a mindennapi életben,mezőgazdaság, gyógyszeripar, ipar. A technikai ammónia-hidrátot a mezőgazdaságban, a nátronpapír, festékek és egyéb termékek előállításában használják. Folyékony műtrágyában a nitrogén olyan formában van, amely könnyen beolvad a növényekbe. Az anyag a legelőnyösebb és leghatékonyabb a legkedvezőbb időszakban az összes növény számára.

Az ammóniavíz termelését 2011 - ben terhelikháromszor kisebb, mint a szilárd szemcsés nitrogénműtrágyák felszabadulása. Folyékony, hermetikusan lezárt acéltartályok tárolására és szállítására használják. A festékek és hajfehérítők bizonyos típusai maró ammóniummal készültek. Minden egészségügyi intézményben ammónia-alkohol - 10 százalékos ammóniaoldat van.
Ammóniumsók: tulajdonságok és gyakorlati jelentőség

Azok az anyagok, amelyeket interakció során kapnakammónium-hidroxid savakkal, a gazdasági tevékenységekben használják. A sók bomlanak fel melegítés közben, feloldódnak vízben, hidrolizálódnak. Kémiai reakciókba lépnek lúgokkal és más anyagokkal. A legfontosabb gyakorlati jelentőséggel rendelkezett a kloridok, nitrátok, szulfátok, foszfátok és ammónium-karbonátok.
Nagyon fontos, hogy kövessük a szabályokat és az intézkedéseketbiztonságot, ha ammóniumiont tartalmazó anyagokkal dolgozik. Az ipari és mezőgazdasági vállalkozások raktárainál, a leányvállalatoknál nem szabad érintkezésbe lépni az ilyen vegyületekkel lime és lúgokkal. Ha a csomagok szivárgási sebessége megszakad, kémiai reakció kezdődik a toxikus gáz felszabadításával. Mindenki, aki az ammóniavízzel és sóival dolgozik, ismernie kell a kémia alapjait. Ha a biztonsági követelmények teljesülnek, az alkalmazott anyagok nem károsítják az embereket és a környezetet.




