Protein-enzim: a protein-enzimek szerepe, tulajdonságai, funkciója a szervezetben
Minden élő sejtben sok vankémiai reakciók. Enzimek (enzimek) - fehérjék specifikus és nagyon fontos funkciókat. Ezeket biokatalizátoroknak nevezik. A fő funkciója az enzimek a szervezetben, hogy felgyorsítsa a biokémiai reakciókat. A kiindulási anyagok, amelyek katalizálják a kölcsönhatása ezeket a molekulákat nevezik szubsztrátok, és a végső vegyületet - termékek.
A természetben az enzimfehérjék csak az élőben dolgoznakrendszereket. A modern biotechnológiában, a klinikai diagnosztikában, a gyógyszeriparban és az orvostudományban, a tisztított enzimekben vagy komplexeikben, valamint a rendszer működtetéséhez és az adatok vizualizálásához szükséges kiegészítő komponensekhez a kutatóhoz van szükség.
Biológiai jelentősége és enzimek tulajdonságai
E molekulák nélkül egy élő szervezet nem tudottműködni. Minden életfolyamat együtt dolgozik az enzimeknek köszönhetően. A fehérje-enzimek fő funkciója a szervezetben az anyagcsere szabályozása. Ezek nélkül a normális anyagcsere lehetetlen. A molekulák aktivitásának szabályozása aktivátorok (induktorok) vagy inhibitorok hatására történik. A kontroll a fehérjeszintézis különböző szintjein működik. Ő is "működik" egy már kész molekulára.
A protein-enzimek fő tulajdonságai -specifikus szubsztrátra. És ennek megfelelően az a képesség, hogy csak egy vagy ritkábban katalizálja a reakciósorozatot. Általában ezek az eljárások reverzibilisek. Mindkét enzim felelős mindkét funkcióért. De ez még nem minden.
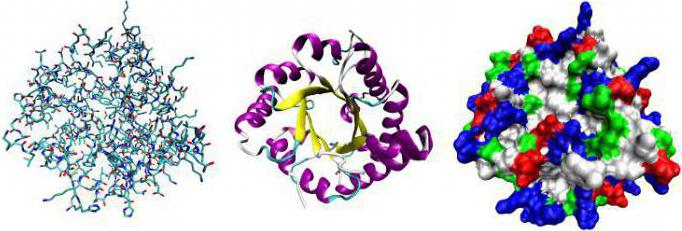
A fehérjeenzimek szerepe elengedhetetlen. Ezek nélkül nem fordulnak elő biokémiai reakciók. Az enzimek hatására a reagensek jelentős energiaköltségek nélkül képesek leküzdeni az aktivációs gátat. A testben nem lehet a hőmérsékletet 100 ° C felett melegíteni, vagy agresszív komponenseket, például vegyi laboratóriumot használni. A fehérje-enzim a hordozóval kombinálódik. A kötött állapotban ez utóbbi módosítása következik. Így működnek a kémiai szintézis során alkalmazott katalizátorok.
Melyek a fehérje-enzim molekula szervezeti szintjei?
Általában ezek a molekulák tercier (globula) vagykvaterner (több kapcsolódó globulátum) fehérje szerkezet. Először lineáris formában szintetizálnak. Ezután be kell hajtani a szükséges szerkezetet. Az aktivitás biztosítása érdekében a biokatalizátornak szüksége van egy bizonyos struktúrára.
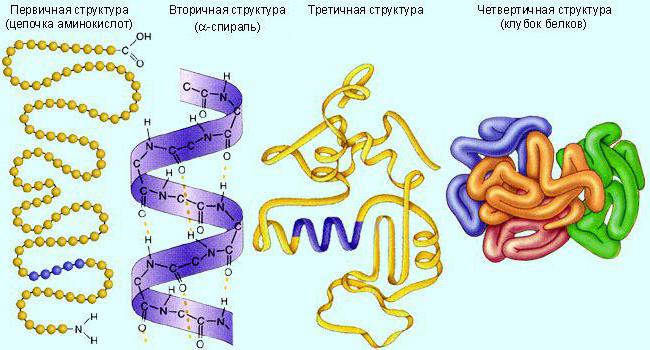
Az enzimeket, más fehérjékhez hasonlóan, melegítéssel, extrém pH-értékekkel, agresszív kémiai vegyületekkel pusztítják el.
Az enzimek további tulajdonságai
Ezek közül az összetevők következő jellemzőit különböztetik meg:
- Sztereospecifitás - csak egy termék keletkezése.
- A regioszelektivitás a kémiai kötés vagy a csoport módosítása egyetlen helyzetben.
- A kémiai szelektivitás csak egy reakció katalízisét jelenti.
A munka jellemzői
Az enzimek specificitási szintje változó. De bármelyik enzim mindig aktív egy adott szubsztrát vagy vegyületcsoport tekintetében, amely hasonló szerkezetű. A nem fehérje katalizátorok nem rendelkeznek ilyen tulajdonsággal. A specifitást a kötési állandóval (mol / l) mérjük, amely 10 értéket ér el-10 mol / l. Az aktív enzim munkája gyors. Egy molekula másodpercenként több ezer millió műveletet katalizál. A biokémiai reakciók gyorsulásának mértéke jelentősen (1000-100000-szer) nagyobb, mint a hagyományos katalizátoroké.
Az enzimek hatása többre épülmechanizmusokat. A legegyszerűbb interakció a szubsztrát egyik molekulájával történik, amelyet egy termék képződik. A legtöbb enzim képes kötni 2-3 különböző molekulát, amelyek bejutnak a reakcióba. Például, az átadás egy atom vagy csoport az egyik vegyületet egy másik, vagy kettős helyettesítés egy „ping-pong”. Ezekben a reakciókban tipikusan csatlakozik egy szubsztrát, és a második funkciós csoport kapcsolódik az enzim által.
Az enzim hatásmechanizmusát a következő módszerekkel vizsgáljuk:
- A köztes és végtermékek meghatározása.
- A szubsztráttal kapcsolatos szerkezeti és funkcionális csoportok geometriai vizsgálata és magas reakciósebesség biztosítása.
- Az enzimgének mutációi és a szintézisében és aktivitásában bekövetkező változások meghatározása.
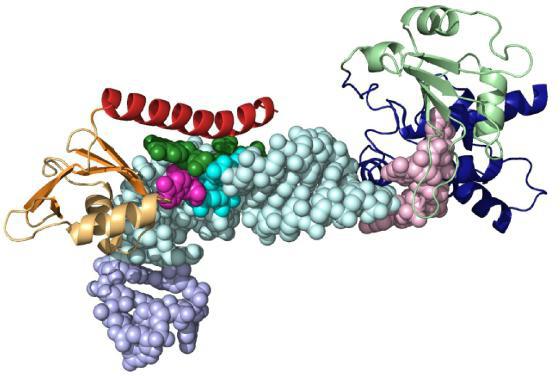
Aktív és kötelező központ
A szubsztrát molekulája sokkal kisebb méretű,mint a fehérje-enzim. Ezért a kötés a biokatalizátor kis számú funkcionális csoportja miatt következik be. Ezek egy aktív központból állnak, amely meghatározott aminosavakból áll. A szerkezetben lévő komplex fehérjékben van egy nem fehérje jellegű protéziscsoport, amely szintén része lehet az aktív központnak.
Különálló enzimcsoportot kell kijelölni. Ezek a molekula koenzim tartósan kötő molekula és mentesülnek belőle. Teljesen képződött protein nevű enzim holoenzim, és amikor eltávolítja kofaktorként - apoenzim. Ahogy koenzimek gyakran jár vitaminok, fémek, származékai nitrogéntartalmú bázisok (NAD - nikotinamid-adenin-dinukleotid, FAD - flavin-adenin-dinukleotid, FMN - flavin-mononukleotid).

A kötőközpont specifikusságot biztosítaffinitást mutat a hordozóhoz. Ennek köszönhetően stabil szubsztrát-enzimkomplex alakul ki. A gömbszerkezet úgy van kialakítva, hogy a felszínen egy bizonyos méretű rés (üreg vagy üreg) van, amely biztosítja a hordozó kötődését. Ez a zóna általában az aktív központtól nem messze található. Az egyes enzimeknek van helyük a kofaktorokhoz vagy fémionokhoz való kötődéshez.
következtetés
A fehérje-enzim fontos szerepet játszik a szervezetben. Ezek az anyagok katalizálja a kémiai reakciókat, felelősek az anyagcsere folyamatáért - anyagcseréért. Minden élő sejtben több száz biokémiai folyamat folyamatosan előfordul, ideértve a vegyületek reduktív reakcióit, felosztását és szintézisét. A nagy energiafelszabadulású anyagok oxidációja folyamatosan előfordul. Ez viszont szénhidrátok, fehérjék, zsírok és komplexek kialakulására fordítódik. A hasítási termékek a szükséges szerves vegyületek szintézisének szerkezeti elemei.