Összehasonlító Reakció: Példák és képlet
A csere, szubsztitúció, vegyület, bomlás reakcióját az iskolai program során figyelembe veszik. Elemezzük az egyes típusok jellemzőit, mutassunk példákat a kölcsönhatásokra.
A fogalom meghatározása
Mi a vegyület reakciója,amelyek példáit az általános oktatási intézményekben a képzés első szakaszában veszik figyelembe? Először is megjegyezzük, hogy a kémiai "kémiai reakció" a második legfontosabb.
A mi világunkban egy vegyület reakciója minden percben történik, amelynek egyenletei ismerősek vagyunk, de nem is gondolunk rájuk.
Például a szénsavas italok előállítása, a tűzifa égetése tipikus példák a vegyületreakciókra.
Ez az eljárás magában foglalja az eredeti vegyi anyagokból származó minőségi és mennyiségi összetételű termékek beszerzését.

A kémiai reakciók jelei
Bármely folyamat, beleértve a vegyület kémiai reakcióját, bizonyos jelek kíséretében:
- a fény vagy a hő kibocsátása;
- a megoldás színe megváltozik;
- gáz-halmazállapotú anyag kibocsátása;
- egy adott szag megjelenése;
- feloldódás vagy kicsapódás.

Reakciófeltételek
A minőségi és mennyiségi összetétel jellemzőitől függően a vegyület kémiai reakciója különböző körülmények között hajtható végre.
Például a 2Ca + O forma kölcsönhatása2 = 2CaO (lime quenching) áramlása előmelegítés nélkül, jelentős mennyiségű hőenergia felszabadításával.
Hogyan alakul a vegyület reakciója helyesen? Az ilyen eljárások egyenletei feltételezik, hogy a kiindulási anyagok írása bal oldalon van, és a reakció terméke a jobb oldalon található.
4Na + O2 = 2Na2O
Az ilyen folyamatok szerves anyagokat tartalmaznak. Így a bizonytalanságra (a többszörös kötés jelenlétére) vonatkozó minőségi reakció a kálium-permanganát kiindulási anyagának oxidációja.

Tűzifa égése
Ez a folyamat az alábbi egyenlet szerint folytatódik:
C + O2 = CO2
Ez egy tipikus vegyes reakció, amelynek példáimár említettük. Mi a lényege ennek a folyamatnak? Amikor a fa kölcsönhatásba lép a levegő oxigénjével, keletkeznek szén-dioxid molekulák. Az eljárást egy új komplex vegyülettel kötő molekula kialakítása kísérte, exoterm reakció.
Lehetséges komplex anyagok reakciójaKapcsolat? Az egyszerű anyagokkal való kölcsönhatás példáit a fentiekben tárgyaltuk, de ez a típus összetett anyagok esetében jellemző. Az ilyen kölcsönhatás tipikus változata mészelhárító reakciónak tekinthető.
CaO + H2O = Sa (OH)2
Ezt a folyamatot jelentős mennyiségű hőenergia kibocsátása is kíséri. A folyamat sajátosságai közül megemlítjük annak spontaneitását.
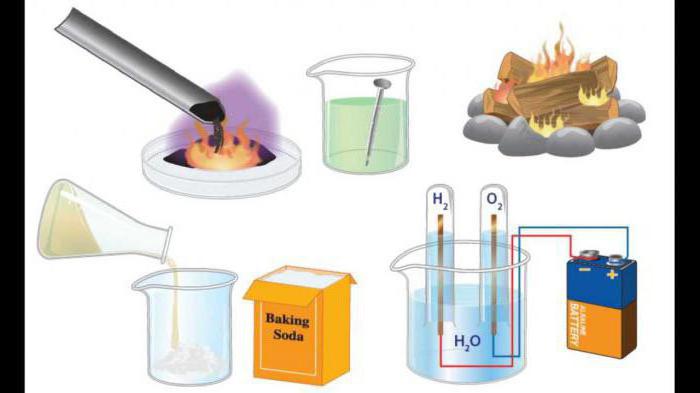
besorolás
A kiindulási anyagok és a reakciótermékek összetétele szerint megkülönböztetjük a vegyület reakcióját, bomlását, helyettesítését, cseréjét. Tekintsük a példáikat, és megadják az ilyen folyamatok meghatározását.
csere - egy összetett vegyület egy részének egy egyszerű anyagának atomok általi helyettesítése.
csatlakozás - Ez az a folyamat, amikor több egyszerű vagy összetett anyagot egy komplexbe egyesítünk. Ilyen folyamatok például szervetlen és szerves kémiából származhatnak.
2H2 + O2 = 2H2 O
Ez a folyamat jelentős mennyiségű hő felszabadulása következtében robbanás lehetséges.
C2 H4 + H2 = C2 H6
Ha a hidrogén etilénen áthalad, a kettős kötés megszakad, ami a korlátozó (telített) szénhidrogént képezi.
terjeszkedés Ezek azok a kémiai reakciók, amelyek egy olyan összetett vegyületből származnak, amely egyszerűbb minőségi és mennyiségi összetételű.
Ioncserélési reakciókés a komplex anyagok között előforduló folyamatok, amelyek eredményeképpen komponensek cseréje történik.
Az ilyen folyamat előfordulásának három feltétele van: gázfejlődés, kicsapódás, alacsony disszociált anyag képződése.
Ezt a kölcsönhatást úgynevezett észterezésnek nevezikvégtermékként a reakció egy észter. A folyamat előrehaladási feltétele a koncentrált kénsav bevezetése a reakcióelegybe.

Az egymással kölcsönhatásba lépő anyagok összesítésének állapota szerinti osztályozás
Az összes kémiai folyamatot ebbe soroljákhomogén és heterogén kölcsönhatásokra jellemző. Az első esetben a kiindulási anyagok és az interakciós termékek ugyanabban az aggregatív állapotban vannak, heterogén fajták esetében pedig eltérő állapot áll rendelkezésre.
Például egy homogén folyamat lenne a következő kölcsönhatás:
H2(gáz) + Cl2(gáz) = 2HCI (gáz)
Heterogén reakcióként a következő lehetőségeket veheti figyelembe:
CaO (tv) + H2O (g) = Ca (OH)2 (rr)

Az oxidáció mértékének megváltoztatásával
A kapott vegyület reakciójaA fentiekben ismertetett (egyszerű anyagokból származó víz képződése) redox folyamat. A folyamat lényege, hogy az elektronok elfogadása és visszatérése.
A vegyület reakciói között vannak olyan eljárások is, amelyek nem járnak az oxidációs fokok változásával, azaz nem OVR-kkel:
CaO + H2O = Sa (OH)2
Az áramlás jellegénél fogva
Attól függően, hogy a folyamat csak előre halad, vagy a reakció ellenkező irányban zajlik-e, a kémiában visszafordíthatatlan és reverzibilis kölcsönhatások vannak.
Például minőségi reakció a szerves anyagokraa vegyület visszafordíthatatlan, mivel oldhatatlan vagy gáznemű anyag képződéséhez vezet. Az ilyen minőségi kölcsönhatás példája az "ezüst tükör" reakció, amely minőségi módszer az aldehidek keverékben történő meghatározására.
A két, egymással ellentétes irányba bekövetkező reverzibilis reakció tipikus változatai közül megemlítjük az észterezési reakciót:
CO2 + H2O = h2CO3
A katalizátor használatáról
Bizonyos esetekben gyorsítószert (katalizátort) kell használni a kémiai folyamat megkezdéséhez. A katalitikus kölcsönhatás egyik példája a hidrogén-peroxid bomlása.

OVR elemzés jellemzői
A leggyakrabban felmerülő kérdések közöttnehézségek az iskoláskorúak számára, az együtthatók eloszlása a reakcióban az elektronikus egyensúly módszerével. Először is vannak olyan szabályok, amelyek szerint minden egyes anyagban meg lehet határozni az egyes elemek oxidációjának mértékét.
Függetlenül attól, hogy egy egyszerű vagy összetett anyagot veszünk figyelembe, összegüknek nullanak kell lennie.
A következő lépés az ilyen anyagok kiválasztása vagyaz egyes kémiai elemek, amelyek megváltoztatták az oxidációs fok értékét. Ezek külön-külön vannak feltüntetve, a "plusz" vagy a "mínusz" jeleit ábrázolja az átvett vagy leadott elektronok számát.
E számok között megtalálható a legkisebb szám, azáltal, hogy osztja meg a kapott és elküldött elektronok számát egész számokkal.
A számok sztereokémiaiak.a javasolt eljárás egyenletében elrendezett koefficiensek. A redox reakciók analízisének egyik fontos lépése az oxidálószer és a redukálószer meghatározása, valamint az előforduló folyamatok rögzítése. Redukálószerként azokat az atomokat vagy ionokat választjuk ki, amelyek az interakció során megnövelték az oxidáció fokát az oxidálószer számára, éppen ellenkezőleg, ez a csökkenés jellemző.
Van-e ez az algoritmus?szerves kémiai változások? A vegyület reakcióját, szubsztitúcióját, bomlását, áramlását változó oxidációs állapotokkal hasonló algoritmus szerint kell mérni.
A szerves vegyületekben az oxidációs állapotok elrendezésében bizonyos tulajdonságok vannak, de összegüknek is nullanak kell lenniük.
Attól függően, hogy az oxidációs állapot pontosan hogyan változik, számosféle kémiai kölcsönhatás létezik:
- aránytalanság - ugyanazon elem oxidációs fokának változása a nagyobb és kisebb oldalon;
- az arányproporcionálás - magában foglalja a redukálószer és az oxidálószer kölcsönhatását, amelyek ugyanazt az elemet tartalmazzák, de különböző oxidációs fokokban.
következtetés
Kis eredményként megjegyezzük, hogy aaz anyagok egymással való kölcsönhatása változások, átalakulások. A kémiai reakciók egy vagy több reagens átalakítása különböző minőségű és mennyiségi összetételű termékekké.
Ha megváltozik a nukleáris átalakulásaz atommagok összetétele, akkor kémiai reakciók esetén ez nem fordul elő, csak a magok és elektronok újraelosztása következik be, ami új vegyületek megjelenéséhez vezet.
A folyamatban lévő folyamatokat a fény, a hő, a szag, a csapadék, a gáz-halmazállapotú anyagok felszabadulása kísérheti.
Számos osztályozási lehetőség létezik.szerves és szervetlen kölcsönhatások különböző okokból. A leggyakoribb lehetőségek közül megemlíthetjük az oxidációs állapotok változását, az aggregáció állapotát, az áramlás visszafordíthatóságát, a folyamat mechanizmusa, katalizátor (inhibitor) használatát.
A kémiai reakciók nemcsak az ipari termelés alapjait, hanem az élet alapját képezik. Az élő szervezetekben zajló anyagcsere folyamatok nélkül a létezés lehetetlen lenne.